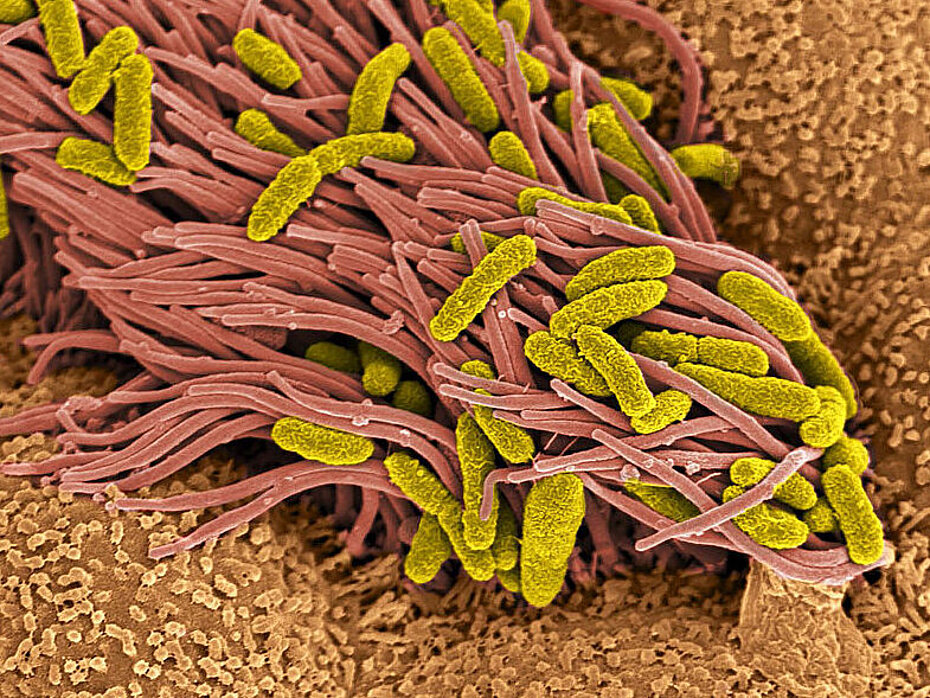
Neuer Mechanismus: Peptide helfen beim Schutz der Lunge vor Krankheitskeimen
In den Atemwegen gibt es winzige Flimmerhärchen, die dafür sorgen, dass Staub, Pollen und Krankheitserreger nicht in die Lunge eindringen können. Wie dieser Schutzmechanismus bei der Abwehr von Bakterien in der Luftröhre und den Bronchien wirkt und welche Rolle Peptide dabei spielen, haben Forscher gerade herausgefunden.
Wie ein Teppich liegen Millionen von Flimmerhärchen, auch Zilien genannt, auf der Schleimhaut der Atemwege. Durch eine andauernde Wellenbewegung dieser winzigen Härchen werden Schleim und an ihm haftende, unerwünschte Substanzen aus den Atemwegen
befördert. Dies ist sehr wichtig, denn ohne diesen Schutzmechanismus würden Fremdstoffe wie Pollen, Bakterien, aber auch Viren aus der Atemluft viel häufiger eine Entzündung der Lunge bewirken. In einem neuen Projekt eines internationalen Forscherteams, das von Professor Bernd Bufe vom Lehrstuhl Molekulare Immunologie und Immunsensorik der Hochschule Kaiserslautern zusammen mit Professor Wolfgang Kummer vom Anatomischen Institut der Universität Gießen initiiert wurde, konnte ein neuer spannender Mechanismus entschlüsselt werden, der unserer körpereigenen Abwehr hilft, Krankheitserreger von den Atemorganen fernzuhalten.
Professor Bernd Bufe, der am Campus Zweibrücken die vielfältigen Wirkungen bakterieller Stoffwechselprodukte auf die Immunabwehr erforscht, hat zusammen mit seinen Kollegen nun herausgefunden, dass die Zilien bei Kontakt mit bestimmten bakteriellen Peptiden schneller schlagen und so die Keime wie auf einem Förderband aus der Lunge in Richtung Luftröhre und Rachen befördern. Von dort gelangt der kontaminierte Schleim durch Herunterschlucken in den Magen und wird anschließend verdaut. Die Bakterien werden dabei unschädlich gemacht. Im Fokus stehen dabei Peptide, die vor allem in Krankheitskeimen vorkommen. Sind sie vorhanden, lösen sie mittels einer ausgefeilten biochemischen Reaktion die Flimmerhärchenbewegung aus.
Im Moment haben die Forscher diesen Mechanismus nur im Maus-Modell komplett entschlüsselt. „Beim Menschen werden wir andere Peptide finden, die diese Reaktion bewirken, weil wir durch andere Bakterien angegriffen werden als Mäuse“, sagt Professor Bufe. Doch ist dieser Schutzmechanismus erst einmal beim Menschen verstanden, bieten sich zahlreiche Möglichkeiten für neue Medikamente. „Wir könnten zum Beispiel in der Zukunft einmal in der Lage sein, Menschen zu helfen, die an Mukoviszidose erkrankt sind“, bemerkt er, „bei diesen Patienten funktioniert der Partikeltransport aus der Lunge nur eingeschränkt.“ Auch zur Vorbeugung bei anderen Risikogruppen für Lungeninfektionen wie Rauchern oder COPD-Kranken könnte ein solcher Wirkstoff einmal zum Einsatz kommen, um sie vor einer Lungenentzündung zu schützen. „Wir haben die Botenstoffe herausgefunden, die diese Veränderung im Zilienschlag auslösen“, erklärt Bufe. „Dies ist sehr wichtig, da wir so Ansatzpunkte haben, um den Zilienschlag gezielt steuern zu können. Ob
auch virale Petptide diese Mechanismen auslösen können wissen wir noch nicht. Aber angesichts der jetzigen Coronainfektionen ist dies schon eine spannende Frage“, erklärt der Forscher. Daher sollen weitere Untersuchungen zeigen, ob dieser körpereigene Mechanismus auch bei der Abwehr von Viren eine Rolle spielt und ob es Unterschiede in der Effektivität dieser Abwehrmechanismen bei unterschiedlichen Menschen gibt.
Die neue Studie, an der die Hochschule Kaiserslautern maßgeblich mitgewirkt hat, ist gerade in der äußerst renommierten Fachzeitschrift Immunity (4/2020) unter dem Titel „Chemosensory cell-derived acetylcholine drives tracheal mucociliary clearance in response to virulence-associated formyl peptides“ erschienen.

Lebende Zellen besser verstehen
Tiefe Einblicke in die jeweiligen Studienobjekte verspricht ein hochmodernes
Fluoreszenz-Mikroskop, das die Hochschule Kaiserslautern gerade angeschafft hat.
Das 500 000 Euro teure Gerät steht am Campus Zweibrücken. Es wurde unter
anderem durch Mittel der Deutschen Forschungsgesellschaft gefördert.
„Mit unserem Floureszenz-Mikroskop haben wir am Campus Zweibrücken jetzt die
Möglichkeit, ein Hochdurchsatz-Screening, wie man es aus der Pharmaindustrie
kennt, durchzuführen“, sagt Prof. Bernd Bufe vom Lehrstuhl Molekulare Immunologie
und Immunsensorik. Das neu angeschaffte Großgerät besteht aus einem Mikroskop
und einer Umweltkammer, in der man lebende Zellen untersuchen kann. So ist man
in der Lage, Zellen, Organismen oder Gewebe mit verschiedenen Chemikalien
stimulieren zu können. Ein Pipetier-Roboter macht die Arbeitsabläufe bei der
Untersuchung wesentlich schneller. Prof. Bufe wird das Gerät dazu nutzen, über die
Immun-Geruch-Interaktion weiter zu forschen. Prof. Karl-Herbert Schäfer, zuständig
für Biotechnologie in der Mikrosystemtechnik, wird Fragen zum enterischen
Nervensystem des Darms untersuchen, während Prof. Tanja Brigadski vom
Lehrstuhl für optische und elektrophysiologische Analyseverfahren in der Biomedizin
zum Thema Wachstumsfaktoren und Lernvorgänge in Neuronen arbeiten wird. Auch
außerhalb der Hochschule sind Kooperationen geplant. So möchte zum Beispiel Prof.
Markus Bischoff vom Institut für Medizinische Mikrobiologie und Hygiene am
Universitätsklinikum Homburg Heilungsprozesse nach Gewebeverletzungen
erforschen. „Wir haben hier ein Gerät, das sich insbesondere für Kurzzeitversuche
eignet, die von Millisekunden bis hin zu einer Stunde dauern“, beschreibt Prof. Bernd
Bufe die Neuanschaffung. Mit dem Mikroskop können die Forscher selbst winzigste
Strukturen erkennen. „Wir haben eine Eindringtiefe bis zu sechs Zellschichten“,
erklärt Prof. Bernd Bufe, „damit kann man kleine Organoide sehen, die zum Beispiel
im Verdauungstrakt wie Mini-Gehirne arbeiten. Wir können buchstäblich dem Darm
beim Denken zuschauen.“ Auch 3-D-Darstellungen lebender Zellen sind für das
Mikroskop kein Problem. „Wir sind in der Lage, tief in eine Zelle hineinzuschauen und
optische Schnitte quer durch eine lebende Zelle zu machen. Das gibt uns neue
Möglichkeiten ganze Zellverbände zu untersuchen“, freut sich der Professor. Das
Gerät arbeitet vollautomatisiert und macht publikationsfähige Abbildungen. Dabei
fallen naturgemäß eine Menge Daten an. Deshalb baut die Hochschule gleichzeitig
eine leistungsfähige IT-Infrastruktur auf.
Interessenten, die das Gerät für komplexe Fragen zu biologischen Prozessen nutzen wollen, sind
willkommen. Kontakt: Prof. Bernd Bufe, Telefon: 0631 3724 – 5410, E-Mail bernd.bufe(at)hs-kl(dot)de

Kann man Keime riechen?
Mäuse meiden erkrankte Artgenossen. Dabei spielt ein spezielles Riechorgan eine
Rolle, mit denen sie infizierte Tiere erkennen können. Eine Studie deckt nun einen
neuen Mechanismus auf, den der Geruchssinn und das Immunsystem gemeinsam
zur Erkennung und Verhinderung von Infektionen nutzen. Was ist aber mit uns
Menschen? Können auch wir drohende Infektionen riechen?
Am Campus Zweibrücken der Hochschule Kaiserslautern untersucht Professor
Bernd Bufe vom Lehrstuhl Molekulare Immunologie und Immunsensorik die Rolle
des Geruchs- und Geschmacksinns bei der Abwehr von Krankheitskeimen. Er ist
Erstautor eines Papers zum Thema, das gerade in der aktuellen Ausgabe von Nature
Communications (DOI 10.1038/s41467-019-12842-x) veröffentlicht wurde. „Wir haben
eine überraschende Entdeckung gemacht“, erklärt Bufe, „es gibt Rezeptoren, die
vom Geruchssinn und dem Immunsystem gemeinsam zur Verhinderung von
Infektionen genutzt werden. Unsere neue Studie zum Riechsystem, die wir in
intensiver Zusammenarbeit mit Prof. Zufall von der Universität des Saarlandes am
Jakobsonschen Organ der Maus durchgeführt haben zeigt, das Mäuse typische
Stoffwechselprodukte von hochgefährlichen Bakterien mit diesem Organ
wahrnehmen und vermeiden können“ Mäuse sind hierfür ideale Studienobjekte, denn
sie besitzen einen sehr ausgeprägten Geruchssinn. Beim Jakobsonschen Organ
handelt es sich um ein spezielles Geruchsorgan der Maus, das wie die
Riechschleimhaut dem olfaktorischen System zugeordnet wird. „Verschiedene
Rezeptoren in diesem Geruchsorgan steuern das Verhalten. Setzt man das Tier dem
Geruch eines erkrankten Artgenossens aus, geht es diesem aus dem Weg. Schalten
wir den dafür zuständigen Rezeptor aus, fällt auch das Vermeidungsverhalten der
Maus weg“, sagt Bufe.
Nach Ansicht des Forschers schützen sich die Tiere mit diesem Mechanismus vor
Infektionen durch Bakterien. Die Arbeitsgruppe um Professor Bufe stellt sich nun die
Frage: Existieren ähnliche Rezeptoren auch in den Sinnesorganen des Menschen
und kann man sie benutzen, um Krankheiten zu erkennen? Noch sind sie nicht
genau bekannt, aber auch beim Menschen gibt es ähnliche Rezeptoren, die beim
Eindringen von Bakterien eingreifen könnten, lange bevor andere Teile des
Immunsystems aktiv werden. Beispielsweise helfen Geruchs- und
Geschmackrezeptoren dabei, von Bakterien verdorbene Nahrung zu erkennen und
zu meiden. „Wir wissen, dass solche Rezeptoren exzellent geeignet sind, komplexe
chemische Signaturen von Krankheitserregern zu erkennen und dass einige von
ihnen auch in Immunzellen vorkommen“, erklärt Bufe. Nach der Hypothese der
Arbeitsgruppe könnten diese Rezeptoren daher auch bei der Immunabwehr helfen.
Ziel weiterer Forschungen ist es deshalb, herauszufinden, ob solche Rezeptoren
beteiligt sind und was nach der Aktivierung der Rezeptoren passiert. Dazu schaut
sich das Team die evolutionäre Entwicklung der Rezeptoren bei unterschiedlichen
Tieren an. „Wir untersuchen die Gründe, warum manche Tierarten durch bestimmte
Bakterien infiziert werden und andere nicht. Dies hilft uns zu verstehen wie wir
Infektionen besser verhindern können“, beschreibt Bufe seine Arbeit an der
Hochschule.
Um die Reaktion der Sinnesrezeptoren auf unterschiedliche Krankheitserreger zu
untersuchen wendet die Forschungsgruppe modernste Methoden der
Hochdurchsatz-Mikroskopie an. Dabei werden große Mengen an Proben
automatisch bearbeitet. Auf spezielle Platten mit zahlreichen kleinen Vertiefungen
wird die zu untersuchende Zellflüssigkeit aufgetragen. Danach werden automatisch
Aufnahmen unter dem Mikroskop gemacht und die dabei entstandenen Bilder mit
Hilfe einer Software ausgelesen. So kann man in kürzester Zeit viele Versuche
gleichzeitig machen. „Mit normaler Mikroskopie würde das Jahre dauern“, beschreibt
Professor Bufe die Vorteile der Hochdurchsatz-Mikroskopie.
Die Arbeitsgruppe hat sich auf die Erforschung von Formylpeptiderezeptoren
spezialisiert. Einzelne Vertreter der Rezeptoren erkennen mehr als 100 000 extrem
unterschiedliche bakterielle Signalpeptide. Diese Signalpeptide der
Krankheitserreger transportieren Eiweißmoleküle an die Zelloberfläche. „Man kann
sich das vorstellen wie ein Barcode oder ein Adressaufkleber, und diese Barcodes
können von den Formylpeptiderezeptoren des Immunsystems wahrgenommen
werden“, sagt Bufe. Rezeptoren für Signalpeptide findet man nicht nur in
Immunzellen, sondern auch an anderen Stellen im Körper, zum Beispiel im Darm.
Deshalb vermutet die Arbeitsgruppe, dass die Wahrnehmung dieser Peptide dem
Körper an vielen Stellen bei der Abwehr von Krankheitskeimen hilft. Ein besseres
Verständnis dieser Prozesse kann zu neuen Therapieansätzen für den Kampf gegen
antibiotikaresistente Bakterien führen sowie zu der Bekämpfung bestimmter
Darmerkrankungen beitragen.